▲全球癌症死亡率在过去几年里展现出明显的下降趋势,这是人类取得的重大进展(图片来源:IQVIA Institute)
当地时间2018年6月1~5日,第54届美国临床肿瘤学会(ASCO)年会在美国芝加哥召开。本届年会的主题为“传递新知:拓展精准医学疆域”,现任美国临床肿瘤学会主席、达纳-法伯癌症研究所Bruce E. Johnson教授将其诠释为“聚焦让精准医学成为现实,通过推动进步和延伸触角,让每一位患者都有机会从中获益”。
ASCO是世界肿瘤学领域最顶级最重要的会议,癌症治疗的最新成果都会第一时间在这个会议上发布,全球癌症治疗领域最重量级的医生、科学家、生物医药企业在此交流。看看本届年会有哪些重磅发布?
1、肺癌——安罗替尼突出重围!
ALTER 0303研究在2017年ASCO会议公布了总体结果。该研究共纳入437例至少接受过两种化疗方案的非小细胞肺癌患者,按2:1的比例随机分配到安罗替尼组和安慰剂组。与安慰剂组相比,安罗替尼组无进展生存期延长3.97个月,总生存期延长3.33个月。今年的ASCO会议上报告安罗替尼病理亚组分析结果,其中腺癌336例,鳞癌76例。腺癌亚组中,与安慰剂组相比,安罗替尼组PFS延长4.16个月,总生存期延长2.7个月。令人欣慰的是在鳞癌亚组中,安罗替尼组PFS延长2.93个月,总生存期延长4.7个月。
该亚组结果证实无论是肺腺癌还是肺鳞癌患者均能从安罗替尼治疗中获益。对于鳞癌,尤其到三线及以上的病人,还能获得和安慰剂相比有4.7个月的总生存期延长,这是很大的突破。从ALTER 0303研究的亚组分析结果中可以看到,安全性在肺腺癌和鳞癌亚组中是有一定差别的。腺癌中3级及以上且发生率大于5%的毒性,主要为低钠血症、高血压。鳞癌中主要为高血压,淋巴细胞数减少、低钠血症、咯血以及Q-T间期延长。鳞癌患者的咯血一直是临床医生和患者担忧的事件。在该研究中,鳞癌患者咯血的比例的确是有升高。在所有级别的咯血中,76例鳞癌患者中,安罗替尼组有17例(36.17%)出现咯血的情况;3级及以上的咯血不良事件中,在安罗替尼组有5例(10.64%),安慰剂组有1例(3.45%)。在所有等级的咯血中,安慰剂组有5例(17.24%)。所以鳞癌患者的咯血事件可能是未来在临床的治疗过程中一个需要关注的问题。
虽然目前安罗替尼的适应症中涵盖部分鳞癌患者,但是由于ALTER 0303研究里只有76例的鳞癌病人,未来上市后还要补充研究,为临床应用提供更多的证据。未来在IV期研究中我们可以进一步对安罗替尼的安全性进行验证,尤其咯血这样的问题。
治疗小细胞肺癌,Keytruda治疗结果喜人!
默沙东(MSD)在2018年ASCO年会上公布了KEYNOTE-158临床2期试验一组的队列中期数据,该试验结果证明抗PD-1药物KEYTRUDA?(Pembrolizumab)作为单一疗法治疗小细胞肺癌(SCLC)的抗癌潜力。
KEYNOTE-158(NCT02628067)是一项全球性、开放性标签、非随机、多组群、多中心的2期临床试验,用于评估Keytruda在包括SCLC在内,在标准疗法中疾病仍出现进展的多种晚期实体瘤患者中的治疗表现。SCLC的队列研究组群包括了有不同生物标记的107名患者,他们每三周接受一次200 mg固定剂量的Keytruda单药治疗。主要终点是总体缓解率(ORR),次要终点是无进展生存期(PFS),总生存期(OS),缓解持续时间(DOR)和安全性。
试验结果显示,SCLC组群患者的ORR为18.7%(95% CI,11.8-27.4),完全缓解率(CRR)为3%,部分缓解率(PRR)为16%。目前尚未达到DOR中位数(范围:2.1至18.7个月),73%的患者的DOR为12个月或更长。中位PFS为2.0个月,6个月和12个月PFS分别为23.7% 和16.8%。中位OS为8.7个月,其中6个月和12个月的OS率分别为57.5%和40.2%。
在肿瘤表达PD-L1水平高的的42名患者中,该疗法的ORR为35.7%,CRR为5%,PRR为31%。此外,中位PFS分别为2.1个月,6个月和12个月PFS分别为38.9% 和28.5%。中位OS为14.9个月,其中6个月和12个月OS率分别为66.0%和53.1%。
默沙东研究试验室肿瘤临床研究部副总裁Jonathan Cheng博士说,默沙东在所有肺癌类型中进行广泛的临床开发项目,Keytruda在SCLC领域的这些新数据强调了我们工作的意义。默沙东对这次2期KEYNOTE-158研究中观察到的缓解率感到兴奋,也将继续在关键性3期KEYNOTE-604试验中评估Keytruda联合化疗,一线治疗小细胞肺癌患者的潜力。
T药联合化疗治疗肺癌一年无进展率翻倍!
据ASCO年会公布的IMpower131试验数据显示,将罗氏公司的Tecentriq加入化疗方案有助于降低晚期肺癌患者疾病进展或死亡的风险。在这项临床试验中,研究人员们招募了1021名晚期肺癌患者,他们被随机分为3组,一组接受Tecentriq、卡铂、以及紫杉醇(A组),一组接受Tecentriq、卡铂、以及白蛋白结合型紫杉醇(B组),另一组则只接受卡铂和白蛋白结合型紫杉醇(C组,对照组)。
研究表明,相对C组,B组将疾病恶化或死亡风险降低了29%。其中B组的1年无进展生存率为24.7%,而对照组的这一数据为12.0%。
在这项试验中,Tecentriq治疗的是肺癌。据美国癌症学会统计,今年将有23.4万名美国人罹患肺癌,其中约有85%是非小细胞肺癌。其中不少肺癌患者在确诊时,病情已经进入了晚期,生存率较低。这些晚期肺癌患者也急需一款创新药物改善他们的病情。值得一提的是,这也是首个在晚期鳞状非小细胞肺癌中展现出显著无进展生存期(PFS)收益的免疫疗法组合疗法。
2、膀胱癌——PD-L1表达可预测免疫治疗疗效!
PD-L1表达是否可以预测PD-1/PD-L1抑制剂在尿路上皮癌(UC)的临床疗效一直具有争议。这很大程度是由于针对不同PD-1/PD-L1抑制剂的不同研究所采用的PD-L1检测平台、判读方法、PD-L1高表达或阳性表达的界值均各有不同,且似乎仍在探索之中。
在今年ASCO大会上,1108研究的研究者通过回顾性模型进一步分析并得出了在该队列中,对于durvalumab治疗,可有效预测OS的PD-L1表达的最佳算法。一项1/2期研究(1108研究)中UC队列的188例患者接受了采用SP263检测平台进行的PD-L1表达的检测。采用回顾性模型评估末例患者随机15个月后TC或IC中PD-L1表达状态对OS、无进展生存(PFS)、客观应答率(ORR)、肿瘤改变及肿瘤缩小的最佳百分比的影响。采用Kaplan-Meier分析探索单一生物标记物或标记物的组合(TC或IC[在IC区域中PD-L1阳性IC的百分比])的算法对OS的影响。
在接受durvalumab治疗的患者中,IC和TC表达的PD-L1均与较高的ORR相关,IC中PD-L1与较长的OS相关。相比TC,IC表达的PD-L1对durvalumab的治疗应答有更强的影响,表现出与OS、PFS、ORR和肿瘤缩小的显著关联(P< 0.05)。当采用TC和IC的联合算法时,即TC25%/IC25%,可获得最佳临床结果。
在UC中,TC25%/IC25%的算法似乎能提供基于疗效和PD-L1表达率的最佳预测价值。需要来自随机试验的更多数据以确认这些结果。
膀胱癌突破疗法缓解率达40%!
Seattle Genetics与安斯泰来(Astellas)在ASCO年会上公布了其在研新药enfortumabvedotin在1期临床中的最新数据。研究表明,这款创新疗法在转移性尿路上皮癌的治疗中,展现出了可喜的成果。
由Seattle Genetics与安斯泰来带来的enfortumab vedotin有望给膀胱癌患者带来福音。这是一款在研的抗体药物偶联物(ADC),由两部分组成:一部分是靶向实体瘤表面常见分子Nectin-4的单克隆抗体,另一部分则是微管破坏剂MMAE。按设计,这款新药能识别带有Nectin-4的癌细胞,对其精准杀伤。不久前,美国FDA曾授予这款新药突破性疗法认定,治疗局部晚期或转移性尿路上皮癌。
针对尿路上皮癌,在一项名为EV-101的临床试验中,enfortumab vedotin展现出了可喜的效果。该试验一共招募了112名患者,他们都罹患转移性尿路上皮癌,且已经接受过化疗的治疗。研究表明,enfortumab vedotin的总体缓解率为41%,其中有4人达到了完全缓解(3.6%)。值得注意的是,在这112名患者中,有89名之前曾接受过免疫检查点抑制剂的治疗。在这个患者群体中,这款创新ADC的总体缓解率为40%。
“ASCO上公布的1期临床数据进一步支持了enfortumab vedotin曾获得的突破性疗法认定,也支持我们进行下一个关键试验EV-201。我们期待能完成试验的入组,招募到接受过铂类化疗,以及免疫检查点抑制剂治疗的患者。在这一患者群体里的积极数据有望让这款新药加速上市。”Seattle Genetics的临床开发高级副总裁Robert Lechleider博士说道。
我们期待这款疗法的开发一路顺利,早日为缺少有效疗法的转移性尿路上皮癌患者带来突破性新药。
3、乳腺癌——ipatasertib联合化疗 即使三阴也不怕!

根据2018年ASCO提供的研究结果,口服AKT抑制剂ipatasertib的一线治疗显示,当联合紫杉醇治疗局部晚期或转移性三阴性乳腺癌(mTNBC)时,总体存活率(OS)有望提高。
Ipatasertib是AKT的ATP竞争性抑制剂。大约40%的TNBC中PI3K / AKT / mTOR通路被激活。这是一条关键的生存途径,我们知道的是,它涉及到关键的细胞过程:代谢、运动、增殖和生长。安慰剂对照II期LOTUS研究的意向治疗人群的中期生存数据显示,随机分入ipatasertib联合紫杉醇组的中位OS为23.1个月,而随机分配至安慰剂+紫杉醇组为18.4个月,延长将近5个月。
生存数据与先前发表的来自LOTUS的数据中使用ipatasertib的无进展生存期(PFS)相一致。ITT人群(n = 124)的中位PFS在ipatasertib组为6.2个月,安慰剂组为4.9个月。在PIK3CA / AKT1 / PTEN改变的肿瘤患者(n = 42)中,ipatasertib对中位PFS的益处与安慰剂相比更为明显(9.0个月vs. 4.9个月)。当根据NGS的PIK3CA / AKT1 / PTEN状态进行分析时,在未改变的亚组中,中位OS从安慰剂组的16.2个月改善到ipatasertib组的23.1个月,1年OS率分别为70%和81%。
一项关于化疗的研究结果吸引了大量关注。研究表明,一种创新化疗能有效地治疗被称为“癌症之王”的胰腺癌。对于这种预后极差的癌症,这款化疗竟能延长患者生命长达20个月!
在一项名为PRODIGE 24/CCTG PA.6的临床试验里,研究人员们招募了大量罹患非转移性胰导管腺癌(PDAC)的患者,这也是最为常见的胰腺癌,占所有病例的90%。这些患者均接受了手术,移除肿瘤。在术后的3-12周,共计493名患者被随机分为两组,一组接受吉西他滨(gemcitabine)的治疗,另一组接受新型化疗mFOLFIRINOX(改良型FOLFIRINOX)的治疗。后者含有四种不同的化疗成分,包括奥沙利铂(oxaliplatin)、亚叶酸钙(leucovorin)、伊立替康(irinotecan)以及5-氟尿嘧啶(5-fluorouracil)。
该研究表明,中位随访长达33.6个月,mFOLFIRINOX组患者的中位无疾病生存期要显著高于吉西他滨组(21.6个月 - 12.8个月)。在中位总生存期上,前者更是要高出近20个月(54.4个月 – 35.0个月)。在额外的生存收益之下,化疗带来的副作用也是可以控制的。
在通常意义上,研究人员都不喜欢“统计不显著”的结果。但今年的ASCO大会上,一项未能达到统计显著性的研究却让人们纷纷点赞。原来,研究人员们发现只要用对了药,乳腺癌患者不需要在术后接受化疗!
乳腺癌是女性中的常见癌症,而术后化疗是常见的治疗手段。我们知道,化疗容易带来较多的副作用,譬如恶心、呕吐、脱发、疲劳、以及感染等。在年轻的女性里,化疗还会引起绝经或不育。这不禁让研究人员们思考,化疗究竟是否是必须的治疗过程?
在一项名为TAILORx的临床试验里,研究人员们招募了10273名女性,他们都罹患HR阳性、HER阴性、腋窝淋巴结阴性的乳腺癌,这也是最常见的乳腺癌类型。研究人员们使用Oncotype DX Breast Recurrence Score测试,评估每一名患者的乳腺癌风险。其中,6711名患者的评分位于11-25分。先前,一些研究表明0-10分的患者不需进行化疗,而26-100分的患者能从化疗中受益。这些分数位于中间的患者该如何治疗,却一直没有定论。
研究人员们把这些患者随机分为两组,一组接受激素疗法,另一组额外使用化疗。在中位数为7.5年的后期随访里,研究人员发现,额外添加化疗,并不能给大部分患者带来更多好处。以9年为界线,两组的无进展生存率(83.3%对84.3%)以及总体生存率(93.9%对93.8%)没有明显区别。
细分之下,研究人员们也发现,50岁以下,且乳腺癌风险为16-25之间的患者能从化疗中收获些许受益。这些实验结果清楚地表明哪些乳腺癌患者需要化疗治疗,哪些乳腺癌患者可以避免化疗。
该研究的主要负责人Joseph A. Sparano博士说道,一半乳腺癌患者为HR阳性、HER阴性、腋窝淋巴结阴性。我们的结果表明通过Oncotype DX Breast Recurrence Score测试的评分,70%的患者有望避免化疗。这样一来,我们能只对剩下30%能从中受益的患者使用化疗,这些数据让我们能用前所未有的精准和自信来使用该测试,针对这一群体进行化疗。这些患者占了乳腺癌患者的一半。我们期待这一应用能尽快得到推广,让更多乳腺癌患者避免化疗之苦。我们期待听到更多这项疗法的好消息,让罹患胰腺癌的患者看到希望。
4、肝癌——Ramucirumab可为高AFP肝癌患者带来生存获益!
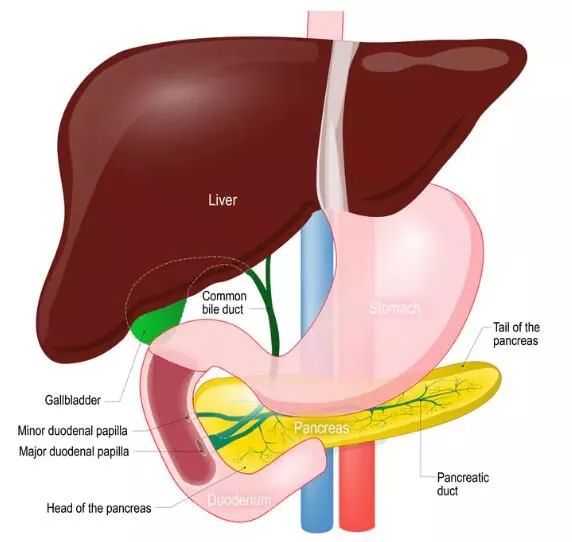
肝癌是一种典型的富血管肿瘤,在肝癌的发生发展过程中,肿瘤血管发挥了非常重要的作用。因此目前肝癌的靶向治疗都是围绕抗血管生成进行的,抗血管生成治疗是肝癌临床实践治疗中非常重要的策略。
REACH-2试验是在REACH试验基础上开展的,REACH试验由美国哈弗大学的医学附属麻省医院美籍华裔学者Andrew X. Zhu教授担任全球PI,针对索拉非尼治疗失败的肝癌病人,对比Ramucirumab与安慰剂之间二线治疗疗效差异,但该试验没有获得预期的结果。但是其亚组分析显示,AFP(甲胎蛋白)超过400ng/ml的患者可以从Ramucirumab的治疗中获益。因此Zhu教授牵头开展了REACH-2试验,发现与安慰剂相比,Ramucirumab无论在总生存还是无进展生存时间上都为患者带来了获益。这个试验具有划时代的意义,它进一步证明了肝癌的二线治疗中,以大分子的单克隆抗体进行抗血管生成治疗,可以取得有临床意义的生存获益。
目前不论是国内还是欧美国家,奥沙利铂都被批准为标准治疗方案。小分子靶向药物方面,可用于一线治疗的有索拉非尼、仑伐替尼,用于二线治疗的有瑞戈非尼、卡博替尼 ;大分子药物方面,Nivolumab和Ramucirumab都为可选药物。
另外,许多肝癌患者合并肝炎,同一个患者,同一时间,同一脏器,存在两种截然不同的疾病。一类是基础肝病,包括肝炎,不管是病毒性肝炎,还是酒精性肝病、脂肪肝、肝硬化,均有可能出现肝功能异常和其他并发症。第二类是高度进展的肝癌。这两种疾病互相影响、形成恶性循环。因此在诊断治疗过程中需要全面兼顾,防止顾此失彼,最近几年中提倡抗病毒治疗和保肝治疗同时进行,这是肝癌治疗取得的另一个进步。
5、白血病——一线伯舒替尼治疗优于伊马替尼!

伯舒替尼是一种Src/Abl双重酪氨酸激酶抑制剂,被批准用于治疗新诊断的慢性期(CP)慢性粒细胞白血病(CML),或对先前治疗耐药或不耐受的CML。该研究比较了≥24个月随访时,一线伯舒替尼和伊马替尼治疗的数据。BFORE是一项正在进行的、开放标签的III期临床研究,共入组536例患者,按1:1比例随机分配接受伯舒替尼(n=268)或伊马替尼(n=268)治疗。
随访12个月时,与伊马替尼组相比,伯舒替尼组表现更高的分子学缓解(MR)和完全细胞遗传学缓解(CCyR)。且这种差异延续到随访24个月后。随访24个月时,两组显示出主要分子学缓解(MMR)差异,但MR4和MR4.5的差异不大。与伊马替尼组相比,伯舒替尼组达到MR和CCyR的时间更短。伯舒替尼组和伊马替尼组分别有6例和7例患者转化为加速期/急变期。随访24个月时,与伊马替尼组相比,伯舒替尼组表现更高的主要分子学缓解(MMR)。研究支持伯舒替尼用于CP CML患者的一线治疗。
6、淋巴瘤——抗CD47抗体联合利妥昔单抗治疗凸显成效!

根据芝加哥2018年ASCO年会上的报告,复发或难治性非霍奇金淋巴瘤(NHL)患者中有一半对抗CD47抗体联合利妥昔单抗(Rituxan)治疗发生应答。22名患者中的8名具有完全的反应,另外3名具有部分反应。其他三名病人病情稳定,疾病控制率达64%。
最常见的治疗相关不良事件(TRAE)是与输液相关的反应,贫血,头痛,发冷和发热。大多数TRAEs为1/2级,包括可通过给予初始剂量和维持剂量减轻的靶向性贫血。
斯坦福大学淋巴瘤临床护理项目负责人Ranjana H. Advani医师表示,Hu5F9-G4(5F9)是一种针对巨噬细胞检查点CD47的第一类抗体,是非霍奇金淋巴瘤中一种很有前景的新型免疫疗法,5F9与利妥昔单抗组合耐受性良好,未达到最大耐受剂量。靶向性贫血是短暂的,并且通过引发和维持给药显着缓解。
研究人员还观察到在滤泡性淋巴瘤和弥漫性大B细胞淋巴瘤(DLBCL)中都具有令人鼓舞的抗肿瘤活性,随访超过6个月的中位缓解时间未达到。在临床前研究中,5F9与利妥昔单抗表现出协同作用,通过增强抗体介导的细胞吞噬作用来破坏淋巴瘤细胞。在15例DLBCL患者中有6例观察到客观反应,7例FL患者中有5例观察到了客观反应。 DLBCL亚组中有5例患者完全缓解,滤泡淋巴瘤亚组中有3例患者完全缓解。5F9在利妥昔单抗治疗难治性疾病患者中表现出有效性。
反应一般发生在头2个月内,中位随访时间超过6个月,11名反应患者中有1名进展。两名DLBCL患者随着时间推移反应加深,从稳定的疾病和部分反应转变为完全反应。中位持续时间尚未达到,最长的完全缓解持续超过14个月。
7.卵巢癌——电场治疗新突破!
Novocure公司,一家致力于利用电场(electricfield)治疗肿瘤的生物技术公司,在2018年ASCO年会上宣布了该公司的肿瘤治疗电场与标准化疗组合治疗复发性卵巢癌患者的临床2期试验结果。试验结果表明,肿瘤治疗电场与紫杉醇(paclitaxel)的组合疗法与紫杉醇单一疗法相比,将患者的无进展生存期(progression free survival, PFS)提高了2倍以上。
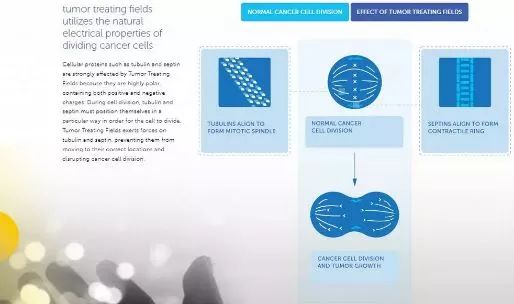
在已经结束的开放标签,含历史性对照的多中心单臂临床2期试验中,30名复发性卵巢癌患者接受了肿瘤治疗电场与紫杉醇构成的组合疗法的治疗。在贝伐单抗(bevacizumab)临床3期试验中的紫杉醇对照组的数据被用来作为这项临床2期试验的历史性对照。
试验结果表明,接受组合疗法治疗的患者的平均PFS为8.9个月,而历史性对照的紫杉醇单一疗法组的PFS为3.9个月。截止到公布结果时,患者群的平均1年存活率为61%。疗效研究结果表明肿瘤治疗电场与紫杉醇构成的组合疗法与紫杉醇单一疗法相比,能够将PFS提高2倍以上,并且改善患者的总生存期。而安全性结果表明这一组合疗法有良好的耐受性和安全性,能够作为一线疗法治疗复发性卵巢癌患者。
随着人们对癌症机理认识的不断加深,个体化癌症诊疗也变得越来越常见。甚至有一些专家们说,当今的癌症治疗领域,你很难找到完全和个体化无关的疗法。
我们在ASCO摘要盘点中曾提到,Loxo Oncology带来的LOXO-292有望成为今年ASCO年会上的一大亮点,而实际结果也没有让研究人员们失望。作为一款具有高度选择性的RET抑制剂,LOXO-292在带有RET融合变异的患者中,取得了77%的总体缓解率。在非小细胞肺癌患者组中,其总体缓解率同样为77%。而且首名参与此研究的非小细胞肺癌患者其持续缓解时间已经超过了10个月,彰显了LOXO-292的持久疗效。在Keytruda在去年获批依照生物标志物治疗癌症之后,Loxo Oncology等公司带来的新药代表了针对遗传特征进行“泛癌症”治疗的新方向。
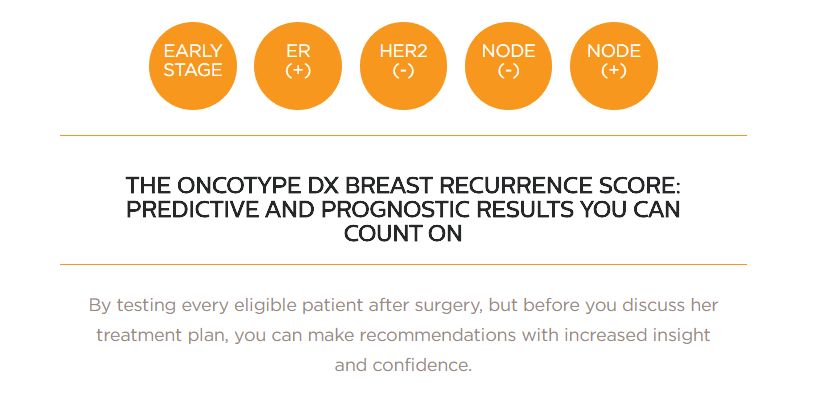
事实上,遗传特征能影响的远不止靶向疗法。在一项名为TAILORx的临床试验里,研究人员们招募了1万多名罹患最常见乳腺癌的女性,并使用Oncotype DX Breast Recurrence Score测试,通过RT-PCR,分析她们体内21条基因的表达情况(16条为癌症相关基因,5条为参考基因)。研究清楚地对乳腺癌患者进行了划分,让她们了解自己究竟能不能从化疗中受益。对于最为常见的乳腺癌类型,有高达70%的患者可以放心告别化疗,避免无谓的副作用困扰。
此外,GRAIL公司的CCGA临床试验也取得了良好的成果。在一项针对肺癌的分组研究里,研究人员们评估了三种不同测序技术在癌症早筛中的应用。研究表明,和肺癌有关的生物信号在不同方法中的强度接近,且随着癌症的进展,这些信号会慢慢增加。在98%的特异性标准下,早期肺癌的筛查率在41%-51%之间,而晚期肺癌的筛查率将近90%。这些结果让我们看到了通过血检对肺癌进行早期筛查的希望。
可以说,我们每一个个体的遗传特征是对抗癌症的重要工具。它不仅能对癌症进行早期筛选,还可以指导常规疗法的使用,或是催生新的治疗方案。个体化的抗癌时代早已到来,我们期待它的尽快普及。
免疫疗法再创佳绩
关于癌症治疗的任何一个大型会议,都逃不开免疫疗法这个话题。在全球癌症研发趋势中,我们曾报道指出,PD-1/PD-L1抑制剂已在超过20种癌症适应症里得到了应用,其中肺癌适应症超过了半数,达到52.4%。今年的ASCO年会上,肺癌免疫疗法再次带来了不少可喜的进展。
在KEYNOTE-042试验中,研究人员们发现与标准化疗相比,Keytruda单药作为一线疗法,在多个患者群体中都显著延长了总生存期(OS),且疗效随着PD-L1表达水平的提高而上升。在PD-L1表达水平大于50%的患者群体里,化疗组的中位OS为12.2个月,而Keytruda组的数据为20.0个月,提升幅度超过60%。这也证实了这款重磅免疫疗法对于肺癌的出色治疗效果。
在CheckMate-227试验中,与标准化疗相比,Opdivo与化疗形成的组合疗法在PD-L1表达量小于1%的肺癌患者群体里,可以显著延长无进展生存期。而Opdivo与低剂量Yervoy联用,也能取得较好的一年无进展生存率(45%,化疗组为8%)。这些结果有望让我们更好地理解哪些人能从免疫联合疗法中受益。
在这两款已获批PD-1抑制剂外,另一些医药公司的在研PD-1抑制剂也在ASCO年会上公布了其最新研究数据。由赛诺菲和再生元共同开发的cemiplimab在皮肤鳞状细胞癌的治疗中,取得了47.5%的缓解率。其预计一年无进展生存率为52.5%,预计一年总生存率为81%;而由诺华带来的spartalizumab则在晚期甲状腺未分化癌中取得了16.7%的总体缓解率。
在PD-L1抑制剂方面,基因泰克的免疫疗法Tecentriq在3期临床试验IMpower131中也取得了出色的成果。相比只接受卡铂和白蛋白结合型紫杉醇的对照组,额外接受Tecentriq治疗的患者可将一年无进展生存率从12.0%提高到24.7%。这也是首个在晚期鳞状非小细胞肺癌中展现出显著无进展生存期(PFS)收益的免疫疗法组合疗法。
在PD-1与PD-L1抑制剂外,另一些原本被人看好的免疫疗法新靶点,表现却没有那么出色。我们期待未来能有更多免疫疗法浮现出水面,与现有的疗法强强联手,更好地治疗患者。
经典疗法迎来升级
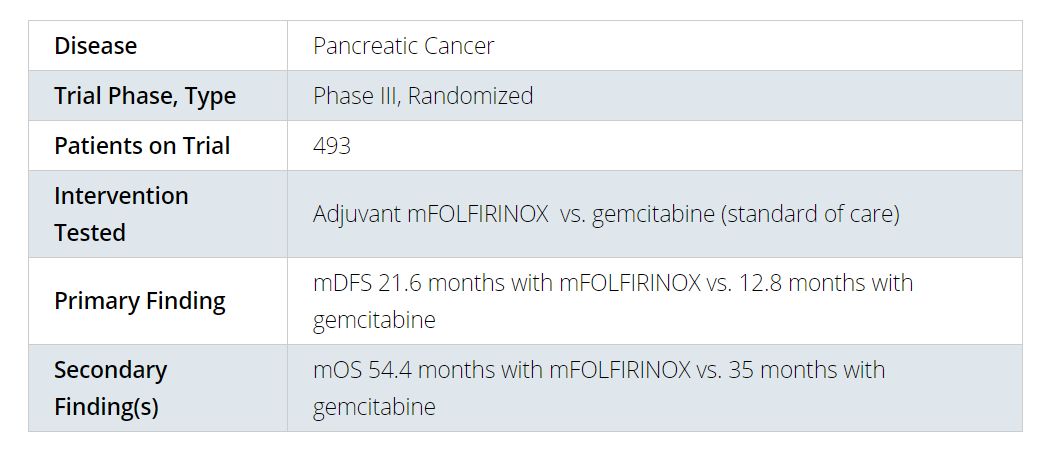
在今年的ASCO年会上,我们也很高兴地看到,一些经典疗法迎来升级,且取得了非常出色的效果。其中,新型化疗mFOLFIRINOX无疑是让人印象最为深刻的几款疗法之一。面对有“癌症之王”之称的胰腺癌,这款由奥沙利铂(oxaliplatin)、亚叶酸钙(leucovorin)、伊立替康(irinotecan)、以及5-氟尿嘧啶(5-fluorouracil)组成的化疗方案取得了54.4个月的中位总生存期,比吉西他滨(gemcitabine)组的35.0个月要高出近20个月!对于早期胰腺癌患者来说,他们的5年生存率不满15%。这款创新化疗方案取得的成绩令人欣喜,也有望为胰腺癌患者带来生命的希望。
在另一项2期临床试验中,Novocure公司的创新肿瘤电场疗法在复发性卵巢癌的治疗中,取得了极为优异的成绩。这款疗法能通过影响细胞中的微管蛋白(tublin)和胞裂蛋白(septin),干扰癌细胞分裂,起到抗癌效果。从历史数据看,倘若采用紫杉醇单一疗法,患者的PFS约为3.9个月。而当紫杉醇与电场疗法联用之后,PFS上升到了8.9个月,提高了2倍以上。在积极的2期临床结果下,研究人员们也打算启动3期临床试验,进一步探索电场疗法的潜力。
在过去的几十年里,人类在对抗癌症的战争中,已经取得了显著成果,让全球癌症死亡率明显下降。我们期待未来听到更多关于癌症治疗的好消息,早日打赢这场战争,为癌症患者们带来福音。
编辑:朱颖婕
责任编辑:李雪林
本文综合自精准医学微信号precisionmedicineres及环球参阅网、生态中国网、众教育、十月呵护等





